Во время похода ребята вели дневник, в котором описывали маршрут и осмотренные достопримечательности. Ниже приведены записи о втором
этапе похода (С→В):
«Отдохнув на привале, мы переправились через реку вброд и начали
подниматься на холм. На ночлег мы расположились в лесу, где под
берёзами разбили палаточный лагерь. На опушке леса, окружённой
соснами, вечером устроили концерт».
По этому описанию и на основе карты учащиеся построили профили
рельефа местности второго участка пути. На каком рисунке изображён
правильно построенный профиль?
1 - Запишем уравнение реакции:
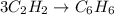
24 грамма бензола - есть масса теоретическая. Наша задача, рассчитать практическую массу. Как нам это сделать? Очень просто. Нам надо рассчитать количество вещества, бензола, которое образуется по уравнению реакции.
Первое что мы сделаем, это рассчитаем количество вещества ацетилена:
Теперь, смотрим на уравнение реакции, что мы видим:
Рассчитываем массу:
Теперь считаем выход:
Один из решения таков:
1)Первым делом найдем молярную массу вещества, для этого мы умножаем плотность паров в-ва на молярную массу воздуха : 3,93*29=114
Итак, М(в-ва) = 114 г/моль.
2)Найдем массу, которая приходится на углерод:
Молярную массу в-ва умножим на омега углерода и разделим на 100:
114*84,21:100=96
3) Найдем массу, которая приходится на водород:
Молярную массу вещества умножим на омега водорода и разделим на 100:
114*15,79:100=18
4) Найдем число атомов углерода в в-ве:
Разделим молярную массу углерода в в-ве на молярную массу одного атома:
96:12=8
5) Т.к. молярная масса одного атома водорода = 1 , то число атомов водорода в в-ве будет равным молярной массе водорода в в-ве, то есть 18
6) Искомое в-во : С8Н18 - алкан.