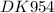с билетами билет 1. 1. периодический закон и периодическая система д. и. менделеева. изменение свойств элементов малых периодов и главных подгрупп в зависимости от положения в периодической системе. 2. : вычисление числа молекул по количеству вещества билет 2 1. предмет . вещества. превращение веществ. и явления. 2. : определить массу вещества по количеству вещества билет 3 1.строение атома: ядро, электронная оболочка. схемы строения атомов элементов iii-го периода. 2. : вычислить массу вещества в растворе с известными массой раствора и массовой долей вещества билет 4 1. ионная связь: характеристика, схемы образования, примеры. 2. : определить массу вещества по количеству вещества билет 5 1.ковалентная связь (неполярная и полярная): характеристика, схемы образования, примеры. 2. : вычисление количества вещества по известному числу молекул билет 6 1.степень окисления. составление формул по степеням окисления. определение степени окисления в бинарных соединениях. 2. : вычислить количество вещества по известной массе вещества билет 7 1.оксиды: определение, номенклатура, классификация, примеры, свойства, применение. 2.: вычислить объем вещества по количеству вещества билет 8 1.основания: определение, номенклатура, классификация, примеры, действие на индикаторы, применение. птб при работе со щелочами. 2.: вычисление количества вещества по известному числу молекул билет 9 1.кислоты: определение, номенклатура, классификация, примеры, действие на индикаторы, применение. птб при работе с кислотами. 2.: вычислить количество вещества по известному объему вещества билет 10 1.соли: определение, номенклатура, классификация, примеры, свойства, применение. 2.: рассчитать объемную долю вещества в газовой смеси. билет 11 1.чистые вещества и смеси разделения смесей 2.: вычислить массовую долю элемента в веществе. билет 12 1. реакции . составление уравнений на основе закона сохранения массы веществ (два примера). 2.: вычислить количество вещества по известному объему вещества билет 13 1.реакции разложения, реакции соединения (определение, примеры уравнений). 2.: вычислить объем вещества по количеству вещества билет 14 1.реакции замещения (определение, примеры, одну из реакций рассмотреть с точки зрения тэд). 2.: вычислить массу вещества в растворе с известными массой раствора и массовой долей вещества билет 15 1.реакции обмена (определение, примеры одну из реакций рассмотреть с точки зрения тэд). 2. : вычислить массовую долю вещества в растворе с известными массой раствора и массой вещества. билет 16 1.ионные уравнения. реакции ионного обмена. реакции ионного обмена проходящие до конца (примеры). 2.: вычислить количество вещества по известной массе вещества билет 17 1.электролиты, неэлектролиты (примеры). электролитическая диссоциация. степень диссоциации. сильные и слабые электролиты. основные положения тэд. 2.: вычислить объем вещества по известным объему вещества и объемной доле билет 18 1. свойства кислот (примеры). одну из реакций рассмотреть с точки зрения тэд. 2.: вычислить массовую долю элемента в веществе. билет 19 1. свойства оснований (примеры). реакцию взаимодействия основания с кислотой рассмотреть с точки зрения тэд. 2. : вычисление числа молекул по количеству вещества билет 20 1.генетическая связь между классами неорганических соединений (ответ подтвердить уравнениями реакции). 2. : рассчитать относительную молекулярную массу вещества.
1) Для начала мы запишем схему гальванического элемента:
Ni | Ni⁺² (0,01 моль/л) || Ag⁺ (1 моль/л) | Ag
2) Далее мы определяем какой из них катод и анод, значит из этого гальванического элемента:
Ni - Анод Ag - Катод
A⁻ : Ni | Ni⁺² (0,01 моль/л) || Ag⁺ (1 моль/л) | Ag : K⁺
3) Теперь записываем гальванические процессы у катода и анода и потом получим уравнение токообразующей реакции :
K⁺ : Ag⁺ + 1e⁻ → Ag⁰ | 1 | | 2 | - окислитель E₁⁰ = +0,80 В
| | 2 | |
A⁻ : Ni⁰ - 2e⁻ → Ni⁺² | 2 | | 1 | - восстановитель E₂⁰ = -0,25 В
2Ag⁺ + 2e⁻ + Ni⁰ - 2e⁻ → 2Ag⁰ + Ni⁺²
2Ag⁺ + Ni⁰ → 2Ag⁰ + Ni⁺² - токообразующая реакция
4) Теперь находим ЭДС у катода и анода по такой формуле:
E(Ni⁺²/Ni) = -0,25 В + 0,059/2 × lg(0,01) = -0,25 В + 0,0295 × lg(10⁻²) = -0,25 В + 0,0295 × (-2) = -0,25 В - 0,059 = -0,309 В
E(Ag⁺/Ag) = 0,80 В + 0,059/1 × lg(1) = 0,80 В + 0,059 × 0 = 0,80 В + 0 = 0,80 В
5) Теперь находим ЭДС по полученным значениях :
ε = E(катод) - E(анод) = E(Ag⁺/Ag) - E(Ni⁺²/Ni) = 0,80 В - (-0,309 В) = 0,80 В + 0,309 В = 1,109 В
ответ: ε = 1,109 В
Решено от :