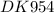Объяснение:
ПРОБЛЕМА
Найти массу раствора серной кислоты, необходимого для полной нейтрализации раствора гидроксида калия.
ЧТО ЕСТЬ ДЛЯ РЕШЕНИЯ
Массовая доля раствора серной кислоты равна 13%.
Масса гидроксида калия в растворе равна 162 грамма.
Уравнение реакции нейтрализации: H2SO4 + 2KOH = K2SO4 + 2H2O
ЧЕГО НЕ ХВАТАЕТ ДЛЯ РЕШЕНИЯ
Найти молярную массу гидроксида калия.
Определить количество вещества гидроксида калия КОН.
Произвести стехиометрический расчёт по уравнению нейтрализации.
Найти молярную массу серной кислоты H2SO4.
Найти массу серной кислоты в растворе.
Определить необходимую массу раствора серной кислоты с указанной массовой долей.
РЕШЕНИЕ
Молярная масса гидроксида калия равна 39 + 16 + 1 = 56 г/моль.
В реакцию вступил гидроксид калия в количестве 162:56 = 2,9 моль.
Согласно уравнению реакции нейтрализации требуемое количество вещества серной кислоты равно 2,9:2 = 1,45 моль.
Молярная масса серной кислоты равна 2*1 + 32 + 4*16 = 98 г/моль.
Масса серной кислоты в растворе равна 1,45*98 = 142,1 грамма.
Необходимая масса раствора серной кислоты с массовой долей 13% равна 142,1:0,13 = 1093 грамма.
ОТВЕТ
Необходимая масса указанного раствора серной кислоты составляет 1093 грамма.
Глюкоза
Так как глюкоза взаимодействует с гидроксидом меди (синим цветом осадка) образуется глюконовая кислота и желтый осадок, а потом его нагревают постепенно в итоге он будет образовываться красный осадок. Вот так пишутся уравнения реакций:
1) CH₂OH-(CHOH)₄-COH + 2Cu(OH)₂ → CH₂OH-(CHOH)₄-COOH + 2CuOH↓ + 2H₂O
2) 2CuOH (t°C) → Cu₂O↓ + H₂O
Где:
CH₂OH-(CHOH)₄-COH - Глюкоза
CH₂OH-(CHOH)₄-COOH - Глюконовая кислота
Cu(OH)₂ - осадок синего цвета ( гидроксид меди (II) )
CuOH - осадок желтого цвета ( гидроксид меди (I) )
Cu₂O - осадок красного цвета ( оксид меди (I) )
Решено от :
Объяснение:
ПРОБЛЕМА
Найти массу раствора серной кислоты, необходимого для полной нейтрализации раствора гидроксида калия.
ЧТО ЕСТЬ ДЛЯ РЕШЕНИЯ
Массовая доля раствора серной кислоты равна 13%.
Масса гидроксида калия в растворе равна 162 грамма.
Уравнение реакции нейтрализации: H2SO4 + 2KOH = K2SO4 + 2H2O
ЧЕГО НЕ ХВАТАЕТ ДЛЯ РЕШЕНИЯ
Найти молярную массу гидроксида калия.
Определить количество вещества гидроксида калия КОН.
Произвести стехиометрический расчёт по уравнению нейтрализации.
Найти молярную массу серной кислоты H2SO4.
Найти массу серной кислоты в растворе.
Определить необходимую массу раствора серной кислоты с указанной массовой долей.
РЕШЕНИЕ
Молярная масса гидроксида калия равна 39 + 16 + 1 = 56 г/моль.
В реакцию вступил гидроксид калия в количестве 162:56 = 2,9 моль.
Согласно уравнению реакции нейтрализации требуемое количество вещества серной кислоты равно 2,9:2 = 1,45 моль.
Молярная масса серной кислоты равна 2*1 + 32 + 4*16 = 98 г/моль.
Масса серной кислоты в растворе равна 1,45*98 = 142,1 грамма.
Необходимая масса раствора серной кислоты с массовой долей 13% равна 142,1:0,13 = 1093 грамма.
ОТВЕТ
Необходимая масса указанного раствора серной кислоты составляет 1093 грамма.
Глюкоза
Объяснение:
Так как глюкоза взаимодействует с гидроксидом меди (синим цветом осадка) образуется глюконовая кислота и желтый осадок, а потом его нагревают постепенно в итоге он будет образовываться красный осадок. Вот так пишутся уравнения реакций:
1) CH₂OH-(CHOH)₄-COH + 2Cu(OH)₂ → CH₂OH-(CHOH)₄-COOH + 2CuOH↓ + 2H₂O
2) 2CuOH (t°C) → Cu₂O↓ + H₂O
Где:
CH₂OH-(CHOH)₄-COH - Глюкоза
CH₂OH-(CHOH)₄-COOH - Глюконовая кислота
Cu(OH)₂ - осадок синего цвета ( гидроксид меди (II) )
CuOH - осадок желтого цвета ( гидроксид меди (I) )
Cu₂O - осадок красного цвета ( оксид меди (I) )
Решено от :