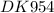Атоми хімічних елементів відрізняються своїми масами. Маса атому позначається символом ma і виражається в одиницях маси кг чи г
хімії застосовується відносна атомна маса Ar.
Відносна атомна маса — це відношення маси атома до атомної одиниці маси.
За атомну одиницю маси обрано 1/12 частини маси атома Карбону. Ця одиниця позначається літерою u.
Відносні атомні маси хімічних елементів наведені у періодичній таблиці. У розрахунках, як правило, використовують значення, округлені до цілих. Виняток — Ar(Cl)= 35,5
1) Для начала мы запишем формулу про закон Фарадея про нахождения массы, потом напишем формулу про нахождения времени необходимого для выделения железа:
m = (M×I×t)/(n×F) ⇒ t = (m(Fe)×n×F)/(M(Fe)×I) (1)
2) Далее напишем для выделения железа из раствора FeSO₄, чтобы узнать сколько количество n (n - число электронов, участвующих в процессе окисления-восстановления):
Атоми хімічних елементів відрізняються своїми масами. Маса атому позначається символом ma і виражається в одиницях маси кг чи г
хімії застосовується відносна атомна маса Ar.
Відносна атомна маса — це відношення маси атома до атомної одиниці маси.
За атомну одиницю маси обрано 1/12 частини маси атома Карбону. Ця одиниця позначається літерою u.
Відносні атомні маси хімічних елементів наведені у періодичній таблиці. У розрахунках, як правило, використовують значення, округлені до цілих. Виняток — Ar(Cl)= 35,5
Дано:
m(Fe) = 2,8 гр
I = 10 А
Найти:
t - ?
1) Для начала мы запишем формулу про закон Фарадея про нахождения массы, потом напишем формулу про нахождения времени необходимого для выделения железа:
m = (M×I×t)/(n×F) ⇒ t = (m(Fe)×n×F)/(M(Fe)×I) (1)
2) Далее напишем для выделения железа из раствора FeSO₄, чтобы узнать сколько количество n (n - число электронов, участвующих в процессе окисления-восстановления):
FeSO₄ → Fe²⁺ + SO₄²⁻
Kt⁻ : Fe²⁺ + 2e⁻ → Fe⁰ | 2 | | | |
2H₂O + 2e⁻ → H₂↑ + 2OH⁻ | 2 | 4 | | 1 |
An⁺ : SO₄²⁻ - не окисляется | | | 4 | |
2H₂O - 4e⁻ → O₂↑ + 4H⁺ | 4 | 4 | | 1 |
Следовательно:
Fe²⁺ + SO²⁻ + 2H₂O + 2H₂O → Fe⁰ + H₂↑ + 2OH⁻ + O₂↑ + 4H⁺ + SO₄²⁻
FeSO₄ + 4H₂O (ПЭТ) → Fe + H₂↑ + 2H₂O + O₂↑ + H₂SO₄
FeSO₄ + 2H₂O (ПЭТ) → Fe + H₂↑ + O₂↑ + H₂SO₄
3) Теперь из электролиза мы узнали что число электронов, участвующих в процессе окисления-восстановления у железа равен 2 ⇒ n = 2
4) Теперь находим время необходимое для выделения железа из формулы (1):
M(Fe) = 56 гр/моль
t = (m(Fe)×n×F)/(M(Fe)×I) = (2,8 гр × 2 × 96500 Кл)/((56 гр/моль × 10 А) = (0,05 моль × 2 × 96500 (А×с))/10 А = 0,1 × 9650 сек = 965 сек ≈ 16,08 мин
ответ: t = 16,08 мин
Решено от :