У нас известна массовая доля углерода в соединении, давайте попробуем вытянуть из нее
число атомов углерода. Мы знаем, что молекулярная масса равняется сумме атомных масс элементов, для нашего спирта "мистер ИКС" она выглядит вот так: 14n + 18, это уравнение справедливо для всей предельных одноатомных спиртов.
Распишем получение массовой доли углерода:
, упростим выражение:
9.0846n + 11.6748 = 12n - видим, что получилось уравнение с одним неизвестным, причем простое, линенйное. Округлим его.
9n + 12 = 12n, сократим на 3
3n + 4 = 4n
отсюда n= 4 , значит спирт имеет вот такуб формулу:
Запишем уравнение горения:
Рассчитаем количество вещества спирта:
n = m/M = 1,48г/74г/моль = 0,02моль
По уравнению реакции:
n(CO2) = 4n(C4H9OH) = 0,02моль*4 = 0,08моль
Теперь, разберемся со второй реакцией, с едким кали:
CO2 + KOH =
Мы не можем предсказать какие точно будут продукты, тут возможны два варианта, либо карбонат калия, либо гидрокарбонат, зависит от того в избытке дана щелочь или нет.
Рассчитаем количество вещества щелочи.
моль
Я сразу нашел количество вещества, в числителе я умножил плотность на объем и на массовую долю, таким образом нашел массу KOH в растворе, а затем разделил на его молярную массу.
Видим, что n(CO2) = 0,08 моль, а n(KOH) = 0,26 моль, значит, CO2 - в недостатке и образуется карбонат калия, пишем уравнение:
CO2 + 2KOH = K2CO3 + H2O
Рассчитаем массу соли.
По уравнению реакции: n(K2CO3) = n(CO2) = 0,08моль
Рассчитаем массу: m = n*M = 0,08моль*202г/моль = 16,16г
СH3COOH + KOH -> CH3COOK + H2O
HCOOH + KOH -> HCOOK + H2O
HCOOH + Ag2O ---> 2Ag + CO2 + H2O
уксусная кислота не реагирует
n(Ag) = m/M = 21,6г/108г/моль =0,2 моль
по уравнению n(HCOOH) в два раза меньше ,чем n(Ag). Значит n(HCOOH) =0,1 моль
общее n(KOH) =m/M = 11,2г/ 56 г/моль = 0,2 моль
по уравнениям n (уксусной) =n щелочи
и n(муравьиной) = n( щелочи)
n щелочи, затраченной на муравьиную кислоту =0,1 моль, значит на уксусную кислоту тоже потратилось 0,1 моль щелочи => n(СН3СООН) =0,1 моль
m(CH3COOH) = m*M = 0,1 моль * 60г/моль = 6 г
Давайте обозначим неизвестный спирт как: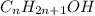
Запишем уравнения протекающих реакций:
У нас известна массовая доля углерода в соединении, давайте попробуем вытянуть из нее
число атомов углерода. Мы знаем, что молекулярная масса равняется сумме атомных масс элементов, для нашего спирта "мистер ИКС" она выглядит вот так: 14n + 18, это уравнение справедливо для всей предельных одноатомных спиртов.
Распишем получение массовой доли углерода:
9.0846n + 11.6748 = 12n - видим, что получилось уравнение с одним неизвестным, причем простое, линенйное. Округлим его.
9n + 12 = 12n, сократим на 3
3n + 4 = 4n
отсюда n= 4 , значит спирт имеет вот такуб формулу:
Запишем уравнение горения:
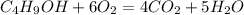
Рассчитаем количество вещества спирта:
n = m/M = 1,48г/74г/моль = 0,02моль
По уравнению реакции:
n(CO2) = 4n(C4H9OH) = 0,02моль*4 = 0,08моль
Теперь, разберемся со второй реакцией, с едким кали:
CO2 + KOH =
Мы не можем предсказать какие точно будут продукты, тут возможны два варианта, либо карбонат калия, либо гидрокарбонат, зависит от того в избытке дана щелочь или нет.
Рассчитаем количество вещества щелочи.
Я сразу нашел количество вещества, в числителе я умножил плотность на объем и на массовую долю, таким образом нашел массу KOH в растворе, а затем разделил на его молярную массу.
Видим, что n(CO2) = 0,08 моль, а n(KOH) = 0,26 моль, значит, CO2 - в недостатке и образуется карбонат калия, пишем уравнение:
CO2 + 2KOH = K2CO3 + H2O
Рассчитаем массу соли.
По уравнению реакции:
n(K2CO3) = n(CO2) = 0,08моль
Рассчитаем массу:
m = n*M = 0,08моль*202г/моль = 16,16г
Изомеры:
CH3 - CH2 - CH2 - CH2 - OH - н - бутиловый спирт(бутанол - 1)
CH3 - CH - CH2 - OH 3 - метилпропанол - 1
|
CH3
CH3 - CH2 - CH - OH 2 - метилпропанол - 1
|
CH3
CH3 - CH2 - CH - CH3 бутанол - 2
|
OH
CH3
|
CH3 - C - CH3 2 метил - пропанол - 2
|
OH
CH3 - O - CH2 - CH2 - CH3 метилпропиловый эфир
СH3 - CH2 - O - CH2 - CH3 диэтиловый эфир
CH3 - CH2 - CH2 - O - CH3 пропилметиловый эфир