Вариант №15
1.Определить вид химической связи в следующих соединениях:
MnBr2 V2O5 S3N2 Cu At
2. Изобразить электронную форму образования связи для соединений:
MnBr2 V2O5 S3N2 Cu At
3. Записать электронную формулу атомов S и N и ионов S+6 и N-3
4. Определить степень окисления в соединениях: MnBr2 V2O5 S3N2 Cu At
5. Составить формулу соединения фосфора с германием
36,12*10^23 : 126,42*10^23
Объяснение:
1) Найдём общее число молекул воды и серной кислоты: N=n*Na (Na - число Авогадро)
1. Вода: 2 * 6,02*10^23 = 12,04*10^23 молекул
2.Серная кислота: 3 * 6,02*10^23 = 18,06*10^23 молекул.
2) Найдём общее число атомов воды и H2SO4: (Для этого надо умножить число молекул на число атомов в формуле)
1. В воде 3 атома, значит: 3 * 12,04*10^23 = 36,12*10^23 атомов
2. В серной кислоте 7 атомов, значит: 7 * 18,06*10^23 = 126,42*10^23 атомов.
Соотношение: 36,12*10^23 : 126,42*10^23
C = 13%
Объяснение:
Запишем уравнение реакции получения HF из NaF
Посчитаем кол-во в-ва NaF (оно равно массе деленной на молярную массу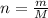 )
)
Так как кол-во в-ва NaF и HF равны, найдем массу HF (они равны, так как равны коэффициенты при формулах в уравнении реакции, это стехиометрический закон)
Процентная концентрация равна массе в-ва / массу р-ра (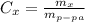 практически тоже, что и массовая доля, масса раствора равна сумме массы растворителя, в нашем случае воды (100г), и растворенного в-ва, в нашем случае плавиковой кислоты HF (15г), то есть в сумме 115г)
практически тоже, что и массовая доля, масса раствора равна сумме массы растворителя, в нашем случае воды (100г), и растворенного в-ва, в нашем случае плавиковой кислоты HF (15г), то есть в сумме 115г)