2AgNO3 + Cu = Cu(NO3)2 + 2Ag Если в реакции участвует 1 моль(64г) меди, то масса пластинки увеличится на 108*2 - 64 = 152г, значит 4,56\152 = 0,03 моль меди прореагировало следовательно AgNO3 вступило в реакцию 0,06 моль или 0,06*170 = 10,2г всего было 476*0,2 = 95,2г, т. е. на бромиды израсходовано 95,2-10,2 = 85г Дальше остается решить систему уравнений: xг уг NaBr + AgNO3 = AgBr + NaNo3 103г 170г 54,7-х 85-у KBr + AgNO3 = AgBr + KNO3 119г 170г Решая систему получим m(NaBr) = 29,1г KBr 25,6г
1) Найдем массы чистой (безводной) серной кислоты в растворах:
ω=m(в-ва)÷m(р-ра)×100% ⇒ m(в-ва)=ω×m(р-ра)÷100%
m₁(H₂SO₄)=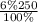 =15 г H₂SO₄
=15 г H₂SO₄
m₂(H₂SO₄)=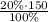 =30 г H₂SO₄
=30 г H₂SO₄
Масса образовавшегося раствора:
m(р-ра)= m₁(р-ра)+m₂(р-ра) = 250+150 = 400 г
Общая масса чистой (безводной) кислоты:
m(H₂SO₄)=m₁(H₂SO₄)+m₂(H₂SO₄)=15+30=45 г
Массовая доля H₂SO₄ в образовавшемся растворе:
ω=m(в-ва)÷m(р-ра)×100% ⇒ ω=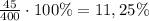
ответ: массовая доля кислоты 11,25%.
2) 2Н₂ + О₂ = 2Н₂О
V(O₂)= 0,6·22,4= 13,44 л
Vm(Н₂)= 22,4 л/моль
Vm(О₂)= 22,4 л/моль
V(Н₂)= х л
V(О₂)= 13,44 л
Расчет по уравнению реакции:
2×22,4 л Н₂ реагирует с 22,4 л О₂
х л Н₂ реагирует с 13,44 л О₂
ответ: водорода потребуется 26,88 л.
3) а) HCl - ковалентная полярная связь
б) O₂ - ковалентная неполярная связь
в) CaF - ионная связь
Если в реакции участвует 1 моль(64г) меди, то масса пластинки увеличится на 108*2 - 64 = 152г, значит 4,56\152 = 0,03 моль меди прореагировало следовательно AgNO3 вступило в реакцию 0,06 моль или 0,06*170 = 10,2г
всего было 476*0,2 = 95,2г, т. е. на бромиды израсходовано 95,2-10,2 = 85г
Дальше остается решить систему уравнений:
xг уг
NaBr + AgNO3 = AgBr + NaNo3
103г 170г
54,7-х 85-у
KBr + AgNO3 = AgBr + KNO3
119г 170г
Решая систему получим m(NaBr) = 29,1г
KBr 25,6г