ᅠᅠГидрокарбонат натрия образован сильным основанием NaOH и слабой угольной кислотой H₂CO₃. Следовательно гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в одну стадию:
ᅠᅠ
(угольная кислота неустойчива и в водных растворах мгновенно распадается на углекислый газ и воду)
2. Гидролиз сульфата меди двухвалентной (CuSO₄):
ᅠᅠСульфат меди образован слабым основанием Cu(OH)₂ и сильной серной кислотой H₂SO₄. Следовательно гидролиз протекает по катиону, образующаяся среда - кислая, гидролиз обратимый, протекает в две стадии:
ᅠᅠ
ᅠᅠ
3. Гидролиз нитрита калия (KNO₂):
ᅠᅠНитрит калия образован сильным основанием KOH и слабой азотистой кислотой HNO₂. Следовательно гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в одну стадию:
1. Гидролиз гидрокарбоната натрия (NaHCO₃):
ᅠᅠГидрокарбонат натрия образован сильным основанием NaOH и слабой угольной кислотой H₂CO₃. Следовательно гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в одну стадию:
ᅠᅠ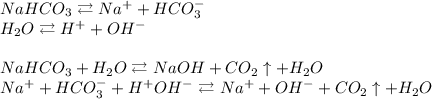
(угольная кислота неустойчива и в водных растворах мгновенно распадается на углекислый газ и воду)
2. Гидролиз сульфата меди двухвалентной (CuSO₄):
ᅠᅠСульфат меди образован слабым основанием Cu(OH)₂ и сильной серной кислотой H₂SO₄. Следовательно гидролиз протекает по катиону, образующаяся среда - кислая, гидролиз обратимый, протекает в две стадии:
ᅠᅠ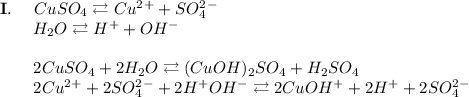
ᅠᅠ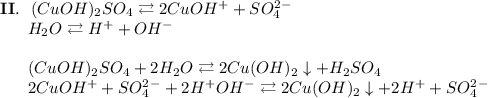
3. Гидролиз нитрита калия (KNO₂):
ᅠᅠНитрит калия образован сильным основанием KOH и слабой азотистой кислотой HNO₂. Следовательно гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в одну стадию:
ᅠᅠ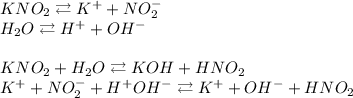
Объяснение: №1. а) Mr(H2SO3)=1*2+32+16*3=2+32+48=82.
б) Mr(Al2S3)=27*2+32*3=54+96=150.
в) Mr(NaNO2)=23+14+16*2=23+14+32=69.
г) Mr(CaF2)=40+19*2=40+38=78.
№2. а) 1) Mr(CaO)=40+16=56.
2) W(Ca)=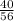 =0,70=70%.
=0,70=70%.
3) W(O)=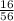 =0,30=30%.
=0,30=30%.
б) 1) Mr(AlCl3)=27+35*3=27+105=132.
2) W(Al)=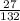 =0,20=20%.
=0,20=20%.
3) W(Cl3)=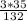 =
=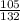 =0,80=80%.
=0,80=80%.
в) 1) Mr(NaCl)=23+35=58.
2) W(Na)=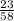 =0,40=40%.
=0,40=40%.
3) W(Cl)=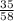 =0,60=60%.
=0,60=60%.
№3. Возьмем 100 грамм этого соединения, тогда масса фосфора 43.66 г, масса кислорода 56.34 г .
Найдем количества вещества:
ню(Р) = 43.66/31 = 1.4 моль .
ню(О) = 56.34/16 = 3.5 моль .
1.4:3.5 разделим на 1.4 будет 1:2.5 умножим на 2 получим 2:5 .
Формула: P2O5 .