Сдоорогие)рассчитать объём(н.у)хлора,образовавшегося при нагревании 8,7 г оксида марганца4 с концентрированной соляной кислотой,содержащей 21,9 г получиться 2,24л,но что-то у меня не получается))
Все тут прекрасно получается) Дружочек, тут задачка с подвохом, у нас даны массу двух исходных веществ, а значит, что какое - то из них находится в избытке, а какое - то в недостатке) Решать задачу надо относительного того вещества, которое в недостатке, потому что, если оно в недостатке, то вероятность пркатически 100% что оно прореагировало полностью, а если в избытке, то мы не можем судить о том, полностью оно прореагировало или нет) Так вот собственно решение:
1 - уравнение:
2 - Теперь работаем с избытком и недостатком. Дабы нам определить какое из них в избытке, а какаое в недостатке, нам надо рассчитаеть их количества вещества.
Для HCl:
= 21,9г/36,5г/моль = 0,6 моль
Для MnO2:
= 8,7г/87г/моль = 0,1 моль
3 - Сравниваем 0,1 и 0,6 - тут явно, что 0.1 < 0.6 - значит, что оксид марганца в недостатке, решаем задачу через него.
Все тут прекрасно получается) Дружочек, тут задачка с подвохом, у нас даны массу двух исходных веществ, а значит, что какое - то из них находится в избытке, а какое - то в недостатке) Решать задачу надо относительного того вещества, которое в недостатке, потому что, если оно в недостатке, то вероятность пркатически 100% что оно прореагировало полностью, а если в избытке, то мы не можем судить о том, полностью оно прореагировало или нет) Так вот собственно решение:
1 - уравнение:
2 - Теперь работаем с избытком и недостатком. Дабы нам определить какое из них в избытке, а какаое в недостатке, нам надо рассчитаеть их количества вещества.
Для HCl:
Для MnO2:
3 - Сравниваем 0,1 и 0,6 - тут явно, что 0.1 < 0.6 - значит, что оксид марганца в недостатке, решаем задачу через него.
4 - По уарвнению реакции:
5 - Считаем объем хлора по формуле:
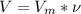 = 0,1моль*22,4л/моль = 2,24 литра
= 0,1моль*22,4л/моль = 2,24 литра