1. Организационный момент.Учитель приветствует учеников, фиксирует отсутствующих.2. Проверка знаний по темам” Химическая связь. Степень окисления”.Самостоятельная работа (15 минут)3. Изучение нового материала.Учитель озвучивает тему урока и цель урока. (Слайд 1,2)Учащиеся записывают в тетради дату, тему урок.Актуализация знаний.Учитель задаёт вопросы классу:Какие виды частиц вы знаете? Имеют ли заряды ионы, атомы и молекулы?Какие виды химических связей вы знаете?Какие вам известны агрегатные состояния веществ?Учитель: «Любое вещество может быть газом, жидкостью и твёрдым веществом. Например, вода. При обычных условиях – это жидкость, но она может быть паром и льдом. Или кислород при обычных условиях представляет собой газ, при температуре -1940 C он превращается в жидкость голубого цвета, а при температуре -218,8°C затвердевает в снегообразную массу, состоящую из кристаллов синего цвета. На этом уроке мы рассмотрим твёрдое состояние веществ: аморфное и кристаллическое». (Слайд 3)
Дано:
m(NaOH) = 4 гр
m(H₂O) = 1 л = 1000 гр
ρ(р-ра NaOH) = 1,2 гр/см³ = 1200 гр/л
-----------------------------------------------------------
Найти:
1) Для начала мы найдем массу раствора NaOH:
m(р-ра NaOH) = m(NaOH) + m(H₂O) = 4 гр + 1000 гр = 1004 гр
2) Далее находим объем раствора NaOH:
V(р-ра NaOH) = m(р-ра NaOH)/ρ(р-ра NaOH) = 1004 гр/1200 гр/л ≈ 0,8367 л ≈ 0,84 л
3) Потом мы находим количества вещества у NaOH:
M(NaOH) = 23+16+1 = 40 гр/моль
n(NaOH) = m(NaOH)/M(NaOH) = 4 гр/40 гр/моль = 0,1 моль
4) Потом мы находим молярную концентрацию раствора NaOH:
ответ: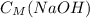 = 0,12 моль/л
= 0,12 моль/л