3) По уравнению реакции видно, что при взаимодействии 1 моля азота ( а это 28 г ) образуется 3 моля аммиака. А так 1 моль любого газа при н.у. занимает объем 22,4 л (дм³), то 3 моля имеют объём 2*22,4 = 44,8 л.
На основании этого составляем пропорцию:
28 г азота 44,8 дм³ аммиака
252 г азота Х дм³ аммиака
Х = 252*67,2/28 = 403,2 дм³
4) 403,2 дм³ - это теоретический выход, а практически получено 262,8 дм³.
Дано:
m(NaOH) = 4 гр
m(H₂O) = 1 л = 1000 гр
ρ(р-ра NaOH) = 1,2 гр/см³ = 1200 гр/л
-----------------------------------------------------------
Найти:
1) Для начала мы найдем массу раствора NaOH:
m(р-ра NaOH) = m(NaOH) + m(H₂O) = 4 гр + 1000 гр = 1004 гр
2) Далее находим объем раствора NaOH:
V(р-ра NaOH) = m(р-ра NaOH)/ρ(р-ра NaOH) = 1004 гр/1200 гр/л ≈ 0,8367 л ≈ 0,84 л
3) Потом мы находим количества вещества у NaOH:
M(NaOH) = 23+16+1 = 40 гр/моль
n(NaOH) = m(NaOH)/M(NaOH) = 4 гр/40 гр/моль = 0,1 моль
4) Потом мы находим молярную концентрацию раствора NaOH:
ответ: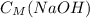 = 0,12 моль/л
= 0,12 моль/л
1) Уравнение реакции:
N₂ + 3H₂ = 2NH₃
2) Находим молярную массу азота:
М(N₂) = 2*14 = 28 г/моль
3) По уравнению реакции видно, что при взаимодействии 1 моля азота ( а это 28 г ) образуется 3 моля аммиака. А так 1 моль любого газа при н.у. занимает объем 22,4 л (дм³), то 3 моля имеют объём 2*22,4 = 44,8 л.
На основании этого составляем пропорцию:
28 г азота 44,8 дм³ аммиака
252 г азота Х дм³ аммиака
Х = 252*67,2/28 = 403,2 дм³
4) 403,2 дм³ - это теоретический выход, а практически получено 262,8 дм³.
Значит практический выход составляет:
(262,8/403,2)*100 = 61,09%