Если тепловой эффект разложения гашеной извести составляет 108кДж/моль, а по условию было использовано 81 кДж, то в реакцию вступило 0,75 моль гашеной извести и было получено 0,75 моль СаО и 0,75 моль воды (что равно 18*0,75=13,5 г )
В следующую реакцию - реакцию взаимодействия негашеной извести СаО с раствором фосфорной кислоты: вступило 0,1*147=14,7 г фосфорной кислоты .
Молярная масса фосфорной кислоты г/моль .
Тогда в реакцию вступило моль фосфорной кислоты и 0,225 моль негашеной извести и получилось 0,075 моль фосфата кальция.
При этом в растворе осталось 0,75-0,225=0,525 моль или 0,525*56 =29,4г СаО, а также 13,5 + 147*0,9 =145,8 г воды.
Молярная масса фосфата кальция г/моль
Тогда масса получившейся соли г.
Масса раствора равна 23,25+145,8 + 29,4 = 198,45 г,
Разложение гашеной извести: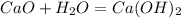
Если тепловой эффект разложения гашеной извести составляет 108кДж/моль, а по условию было использовано 81 кДж, то в реакцию вступило 0,75 моль гашеной извести и было получено 0,75 моль СаО и 0,75 моль воды (что равно 18*0,75=13,5 г )
)
В следующую реакцию - реакцию взаимодействия негашеной извести СаО с раствором фосфорной кислоты: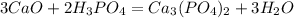 вступило 0,1*147=14,7 г фосфорной кислоты
вступило 0,1*147=14,7 г фосфорной кислоты  .
.
Молярная масса фосфорной кислоты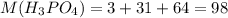 г/моль .
г/моль .
Тогда в реакцию вступило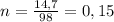 моль фосфорной кислоты и 0,225 моль негашеной извести и получилось 0,075 моль фосфата кальция.
моль фосфорной кислоты и 0,225 моль негашеной извести и получилось 0,075 моль фосфата кальция.
При этом в растворе осталось 0,75-0,225=0,525 моль или 0,525*56 =29,4г СаО, а также 13,5 + 147*0,9 =145,8 г воды.
Молярная масса фосфата кальция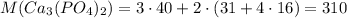 г/моль
г/моль
Тогда масса получившейся соли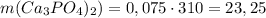 г.
г.
Масса раствора равна 23,25+145,8 + 29,4 = 198,45 г,
а массовая доля соли составляет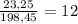 %
%
1. количество вещества (моли)=концентрация (с)*объем(v)
объем должен быть в литрах
1)n(серной кислоты) которое должно быть = 0,5 л * 0,1 М= 0,05 моль
2)0,05 моль *98г/моль = 4,9 грамм - масса серной кислоты
3) 4,9 г : 0,1 = 49 грамм - масса РАСТВОРА серной кислоты
4)49 г : на плотность (1,8356 г/мл) = 26,7 мл
вообще, серная кислота диссоциирует полностью, так как сильная кислота, то есть ее ст дис = 100%, тем более она разбавленная
если она диссоциирует полностью, то молярная концентрация водорода [H] = 2 [H2SO4]. то есть 0,1 моль
рН=-㏒[H] только логарифм десятичный. отсюда рН = 1