Малахит хрупкий материал зелёного цвета имеет формулу cuco3 (oh2) его считают русским камнем, слава его началась с1635р после открытия уральских малихитовых рудников которые сейчас полностью исчерпаны. Определите массовую долю всех элементов в этом соединении.
1. Докажите опытным путём состав: а) гидроксида кальция; б) сульфата аммония.
а) Проведём качественную реакцию на гидроксид-ион. Для этого воспользуемся индикаторами. Гидроксид кальция - основание малорастворимое, но тем не менее некоторое количество растворяется, следовательно среду изменять будет. Возьмём индикатор фенолфталеин, добавим его в пробирку с гидроксидом кальция, в результате раствор частично изменит цвет на малиновый - следовательно среда щелочная (слабощелочная).
б) Проведём качественную реакцию на сульфат-ион. Для этого возьмём любую растворимую соль бария (по стандарту - хлорид бария), добавим его в раствор с сульфатом аммония. В ходе реакции выпадает белый осадок - сульфат бария. Реакция выглядит следующим образом:
ᅠᅠ
2. Испытайте растворы нитрата натрия, карбоната натрия и нитрата цинка раствором индикатора или индикаторной бумагой, и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза:
1. Нитрат натрия - соль, образованная сильным основанием NaOH и сильной кислотой HNO₃, гидролиз протекать не будет, среда нейтральная. Это можно доказать следующим путём: возьмём индикатор метиловый оранжевый, добавим его в раствор нитрата натрия, в результате цвет изменится на оранжевый. Это и есть признак нейтральной среды.
2. Карбонат натрия - соль, образованная сильным основанием NaOH и слабой кислотой H₂CO₃. Гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в две стадии:
ᅠᅠ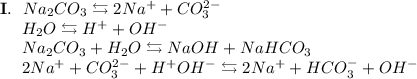
ᅠᅠ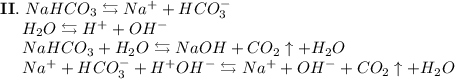
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на жёлтый, следовательно реакция среды щелочная.
3. Нитрат цинка - соль, образованная слабым основанием Zn(OH)₂ и сильной кислотой HNO₃. Гидролиз протекает по катиону, образующаяся среда - кислая, гидролиз обратимый, протекает в две стадии:
ᅠᅠ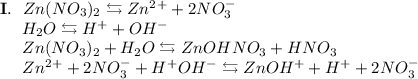
ᅠᅠ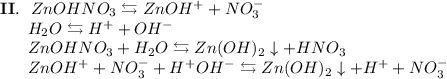
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на красный, следовательно реакция среды кислая.
3. Практически осуществите все следующие превращения: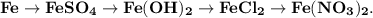
1. Получим сульфат железа путём реакции железа и разбавленной серной кислоты:
ᅠᅠ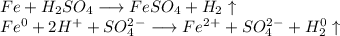
С точки зрения ОВР:
ᅠᅠ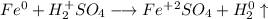
ᅠᅠ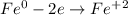 | 2 | 1 | окисление
| 2 | 1 | окисление
ᅠᅠ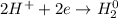 | 2 | 1 | восстановление
| 2 | 1 | восстановление
ᅠᅠFe - восстановитель, H₂SO₄ (2H⁺) - окислитель.
2. Получим гидроксид железа путём реакции сульфата железа и гидроксида калия:
ᅠᅠ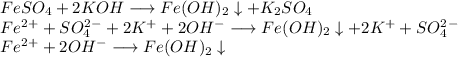
3. Получим хлорид железа путём реакции гидроксида железа и хлороводородной кислоты:
ᅠᅠ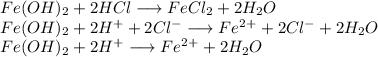
4. Получим нитрат железа путём реакции хлорида железа и азотной кислоты:
II I
MgCl₂
Объяснение:
т.к. Mg стоит во второй группе хим. элементов его валентность будет равна II (валентность обозначается римскими цыфрами), а Cl стоит в седьмой группе - его валентность мы определяем следующим образом: 8 (кол-во групп) - 7 (та группа, в которой стоит сам хлор) = 1 валентность хлора
дальше расставляем полученные значения над элементами и просто используем "правило крест-накрест", т.е. валентность Mg будет обозначать кол-во атомов хлора (цифра, что расположена внизу) в данном хим. соединении, а валентность хлора - кол-во атомов Mg
Примечание: подобное правило работает не во свех хим. формулах