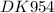Формула искомого амина С2H5NH2 (общее количество атомов в молекуле - 10 )
Объяснение:
Общая формула амина (СnH2n+1NH2) или R-NH2
Общая формула нитросоединения из которого можно получить предельный первичный амин R-NO2
Реакция гидрирования (восстановления) проходит по уравнению
R-NO2 + 3H2 = R-NH2 + 2H2O
Из уравнения реакции следует что количество вещества амина равно количеству вещетства нитросоединения. Обозначим R - как искомую величину, остаток NO2 - по его молярной массе 46, NH2 - 16, тогда получим уравнение. Решив которое найдем молярную массу R
Формула искомого амина С2H5NH2 (общее количество атомов в молекуле - 10 )
Объяснение:
Общая формула амина (СnH2n+1NH2) или R-NH2
Общая формула нитросоединения из которого можно получить предельный первичный амин R-NO2
Реакция гидрирования (восстановления) проходит по уравнению
R-NO2 + 3H2 = R-NH2 + 2H2O
Из уравнения реакции следует что количество вещества амина равно количеству вещетства нитросоединения. Обозначим R - как искомую величину, остаток NO2 - по его молярной массе 46, NH2 - 16, тогда получим уравнение. Решив которое найдем молярную массу R
225X+3600=135X+6210
90X=2610
X=29
Подставив в общую формулу найдем n
CnH2n+1=29 => 12n+2n=28 => 14n=28 = > n=2
Формула амина С2H5NH2 - этиламин
1) Для начала мы запишем схему гальванического элемента:
Ni | Ni⁺² (0,01 моль/л) || Ag⁺ (1 моль/л) | Ag
2) Далее мы определяем какой из них катод и анод, значит из этого гальванического элемента:
Ni - Анод Ag - Катод
A⁻ : Ni | Ni⁺² (0,01 моль/л) || Ag⁺ (1 моль/л) | Ag : K⁺
3) Теперь записываем гальванические процессы у катода и анода и потом получим уравнение токообразующей реакции :
K⁺ : Ag⁺ + 1e⁻ → Ag⁰ | 1 | | 2 | - окислитель E₁⁰ = +0,80 В
| | 2 | |
A⁻ : Ni⁰ - 2e⁻ → Ni⁺² | 2 | | 1 | - восстановитель E₂⁰ = -0,25 В
2Ag⁺ + 2e⁻ + Ni⁰ - 2e⁻ → 2Ag⁰ + Ni⁺²
2Ag⁺ + Ni⁰ → 2Ag⁰ + Ni⁺² - токообразующая реакция
4) Теперь находим ЭДС у катода и анода по такой формуле:
E(Ni⁺²/Ni) = -0,25 В + 0,059/2 × lg(0,01) = -0,25 В + 0,0295 × lg(10⁻²) = -0,25 В + 0,0295 × (-2) = -0,25 В - 0,059 = -0,309 В
E(Ag⁺/Ag) = 0,80 В + 0,059/1 × lg(1) = 0,80 В + 0,059 × 0 = 0,80 В + 0 = 0,80 В
5) Теперь находим ЭДС по полученным значениях :
ε = E(катод) - E(анод) = E(Ag⁺/Ag) - E(Ni⁺²/Ni) = 0,80 В - (-0,309 В) = 0,80 В + 0,309 В = 1,109 В
ответ: ε = 1,109 В
Решено от :