1. Водород - одновалентен, а в его молекуле имеется 2 атома, значит если мы разделим его молярный объем на 2, то получим его эквивалентный объем, т.е. = 22,4/2=11,2л.
2. Чтобы найти молярную массу металла, нужно умножить его на предполагаемые валентности(чаще всего это 1, 2, 3, 4...). Если мы умножим эквивалент на 2 то выйдет 40 г/моль, а это Ca(II). Т.к. у нас не дается какая кислота взята именно, мы не знаем ск-ко водорода выделилось, поэтому пользуемся законом эквивалентности:
11.2 л; 0,252 л.
Объяснение:
1. Водород - одновалентен, а в его молекуле имеется 2 атома, значит если мы разделим его молярный объем на 2, то получим его эквивалентный объем, т.е.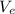 = 22,4/2=11,2л.
= 22,4/2=11,2л.
2. Чтобы найти молярную массу металла, нужно умножить его на предполагаемые валентности(чаще всего это 1, 2, 3, 4...). Если мы умножим эквивалент на 2 то выйдет 40 г/моль, а это Ca(II). Т.к. у нас не дается какая кислота взята именно, мы не знаем ск-ко водорода выделилось, поэтому пользуемся законом эквивалентности:
0,45--------------------------x x=0.252 л.
20-----------------------------11.2 (где 20 - Е(Са); 11,2 -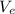 (Н2); 0,45 - m(Ca)).
(Н2); 0,45 - m(Ca)).
а)
1) CO₂ + BaO (t°) → BaCO₃
2) BaCO₃ + CO₂ + H₂O → Ba(HCO₃)₂
3) Ba(HCO₃)₂ + 2HCl → BaCl₂ + 2H₂O + 2CO₂↑ - молекулярное уравнение
Ba²⁺ + 2HCO₃⁻ + 2H⁺ + 2Cl⁻ → Ba²⁺ + 2Cl⁻ + 2H₂O + 2CO₂↑ - полное ионное уравнение
2HCO₃⁻ + 2H⁺ → 2H₂O + 2CO₂↑ - сокращенное ионное уравнение
4) BaCl₂ + FeSO₄ → BaSO4↓ + FeCl₂ - молекулярное уравнение
Ba²⁺ + 2Cl⁻ + Fe²⁺ + SO₄²⁻ → BaSO4↓ + Fe²⁺ + 2Cl⁻ - полное ионное уравнение
Ba²⁺ + SO₄²⁻ → BaSO4↓ - сокращенное ионное уравнение
б)
1) Al₂O₃ + 2NaOH (t°) → 2NaAlO₂ + H₂O
2) NaAlO₂ + 4HNO₃ → Al(NO₃)₃ + NaNO₃ + 2H₂O
3) Al(NO₃)₃ + 3KOH → Al(OH)₃↓ + 3KNO₃ - молекулярное уравнение
Al³⁺ + 3NO₃⁻ + 3K⁺ + 3OH⁻ → Al(OH)₃↓ + 3K⁺ + 3NO₃⁻ - полное ионное уравнение
Al³⁺ + 3OH⁻ → Al(OH)₃↓ - сокращенное ионное уравнение
4) Al(OH)₃ + HNO₃ → Al(OH)₂NO₃ + H₂O