Из предложенного перечня выберите все суждения, которые справедливы для химической реакции между медью и азотной кислотой, протекающей в открытой колбе: 1) скорость реакции увеличивается при увеличении давления
2) скорость реакции не зависит от концентрации кислоты
3) при повышении температуры скорость выделения газа возрастает
4) количество меди не влияет на скорость реакции
5) относится к реакциям замещения
Задача 1
w(Zn)=1-0,25=0,75
m(Zn)=m(смеси)*w(Zn)=30*0,75=22,5 грамм
n(Zn)=m/M=22,5/65=0,3 моль
Zn + 2HCl → ZnCl2 + H2
n(Zn)=n(ZnCl2)=0,3 моль
m(ZnCl2)=0,3*135=40,5 грамм
ответ: m(ZnCl2)=40,5 грамм
Задача 2
n(Ca(OH)2)=m/M=8/74=0,1 моль
CO2(недост.) + Ca(OH)2(изб.) → CaCO3↓ + H2O
n(Ca(OH)2)=n(CaCO3)=0,1 моль
m(CaCO3)=0,1*100=10 грамм
ответ: m(CaCO3)=10 грамм
Задача 3
Mr(O2)=Ar(O)*2=16*2=32
M(O2)=32 г/моль
n(O2)=m/M=22/32=0,7 моль
V(O2)=n*Vm=0,7*22,4=15,68 литров
No(O2)=n*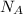 =0,7*6,02*
=0,7*6,02*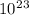 =4,214*
=4,214*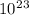 молекул
молекул
ответ: V(O2)=15,68 литров; No(O2)=4,214*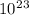 молекул
молекул
х г 100 г
120 г 24 г
1. Сначала определим чистую массу кислоты:
при взаимодествии 120 г кислоты необходимо взять 24 г магния, а
при --//--//-- х г_______________________100 г, откуда
х=120*100/24=500 г
2. Но эта масса - 500 г - всего лишь 7%,а
у г - масса раствора______100%, откуда у=500*100/7=7143 г
3.Чтобы узнать объем, то необходимо массу раствора поделить на его плотность:
V(раствора)=m(раствора/р=7143/1,008=7 086 мл или приблизительно 7 л