Из 1 килограмма пирита в три стадии была получена серная кислота. определите массу серной кислоты, если пирит содержит 10 процентов примесей, а выходы продукта реакции на трёх стадиях получения серной кислоты равны соответсвенно 0,80; 0,70; 0,95 ответ должен получиться: 782 грамма
3. 0,4 моль
4. 1,806 * 10^{23} молекул
5. 0,2 моль
Объяснение:
3.
Дано:
N(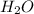 ) = 24 *
) = 24 * 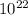
Найти: n(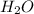 )
)
n = N/Nа. = (24 *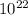 )/(6,02 *
)/(6,02 * 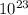 ) = 0,4 моль
) = 0,4 моль
ответ: 0,4 моль
4.
Дано:
n(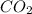 ) = 0,3 моль
) = 0,3 моль
Найти: N(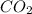 )
)
n = N/Nа. --> N = nNа. = 0,3 * 6,02 *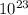 = 1,806 * 10^{23}
= 1,806 * 10^{23}
ответ: 1,806 *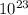 молекул
молекул
5.
Дано:
N(Cu) = 1,2 *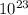 атомов
атомов
Найти: n(Cu)
n = N/Nа. = (1,2 *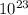 )/(6,02 * 10^{23}) = 0,2 моль
)/(6,02 * 10^{23}) = 0,2 моль
ответ: 0,2 моль
Формулы:
n = N/Nа. = m/M = V/Vm., где
n - количество вещества (моль), N - количество молекул/атомов, Nа. - постоянное число Авогадро (6,02 * 10^{23}), m - масса вещества (г), M - молярная масса, V - объём (л), Vm - молярный объём (22,4 л)
По таблице растворимости находим что вещество AgI является нерастворимым, а значит выпадает в осадок (это будет такой желтый осадок). Можно составить РИО для этой реакции, и оно будет выглядеть следующим образом: Al3+ + 3I- +3Ag+ + NO3-=3AgI + Al3+ + 3NO3- и соответственно сокращенное РИО будет выглядеть Так: 3Ag+ + 3I-=3AgI сокращаем тройки перед ионами и веществом и получаем конечное РИО: Ag+ + I-=AgI (в осадке). Итак, признаком протекания данной хим.реакции является выпадение желтого осадка AgI/