Горению этана (С2Н6) соответствует уравнение реакции и тип термохимической реакций: I. 2С2Н6 + 5О2 = 4СО+ 6Н2О + Q
II. 2С2Н6 + 7О2 = 4СО2 + 6Н2О + Q
III. 2С2Н6 + 3О2 = 4С+ 6Н2О + Q
А) верно только I и III, экзотермическая реакция
B) верно только I, эндотермическая реакция
C) верно только I, экзотермическая реакция
Уравнение реакции:
CnH2n+1COOCnH2n+1 + NaOH = CnH2n+1COONa + CnH2n+1OH
Рассчитаем массу щелочи, для этого воспользуемся законом Ломоновоса - Лавуазье о сохранении массы вещества:
m(эфира) + (NaOH) = m(соли) + m(спирта)
6 + m(NaOH) = 6.8 + 3,2
6 + m(NaOH) = 10
m(NaOH) = 10 - 6
m(NaOH) = 4г
Рассчитаем количество вещества щелочи:
n = m/M = 4г/40г/моль = 0,1моль
По уравнению реакции:
n(CnH2n+1COONa) = n(NaOH) = 0,1моль
Рассчитаем молярную массу соли:
M = m/n = 6,8г/0,1моль = 68г/моль
Рассчитаем число атомов углерода - n
14n + 68 = M - следствие из формулы общего гомологического ряда
14n + 68 = 68
14n = 0
n = 0
Кислота - HCOOH - муравьиная
По уравнению реакции:
n(спирта) = n(NaOH) = 0,1моль
Рассчитаем молекулярную массу спирта:
M = m/n = 3,2г/0,1моль = 32г/моль
Рассчитаем число атомов углерода - n
14n + 18 = M - следствие из формулы гомологического ряда спиртов
14n + 18 = 32
14n = 14
n = 1
Спирт: CH3OH -метиловый спирт
Эфир: HCOOCH3 - метилформиат
ответ: НСООСН3 - метилформиат.
11,1 г 3,36 л
х г 22,4 л
1.Определим по плотности массу раствора:
m(раствора)=V*p=35,5*1,04=37 г
2. Узнаем какова чистая масса кислоты в растворе:
m(кислоты)=m(раствора)*w(кислоты)=37*0,3=11,1 г
3. Подставив в уравнение реакции эту массу,найдем,по сути,относительную молекулярную массу кислоты:
при взаимодействии 11,1 г кислоты выделяется 3,36 л углекислого газа, а
при --//--//-- х г____________________22,4 л, откуда
х=11,1*22,4/3,36=74 г
4.Вспомнив формулу по вычислению молекулярной массы вещества,подставим полученную массу в нее и получим уравнение: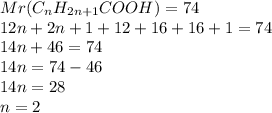
Подставив в общую формулу карбоновых кислот,получим формулу конкретной кислоты: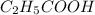 - это пропановая(пропионовая) кислота
- это пропановая(пропионовая) кислота