Для расчетов пользуемся уравнением Аррениуса:
К – константа скорости реакции,
е – основание натурального логарифма,
Т – температура, в К,
R – молярная газовая постоянная 8,31 Дж/моль*К
Еа – энергия активации, Дж/моль,
А – предэкспоненциальный множитель, показывает общее число столкновений.
(A - в процессе решения задачи сократится)
Константа скорости реакции в отсутствии катализатора равна:
Константа скорости реакции в присутствии катализатора равна:
Увеличение скорости реакции определяется из соотношением :
Логарифмируем выражение и получаем:
Вот так задача..
Для расчетов пользуемся уравнением Аррениуса:
К – константа скорости реакции,
е – основание натурального логарифма,
Т – температура, в К,
R – молярная газовая постоянная 8,31 Дж/моль*К
Еа – энергия активации, Дж/моль,
А – предэкспоненциальный множитель, показывает общее число столкновений.
(A - в процессе решения задачи сократится)
Константа скорости реакции в отсутствии катализатора равна:
Константа скорости реакции в присутствии катализатора равна:
Увеличение скорости реакции определяется из соотношением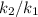 :
:
Логарифмируем выражение и получаем:
Вот так задача..