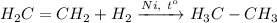Дата: 05.02.2021 Тема 36. Практическая работа № 3. «Решение экспериментальных задач»
Цель: научиться осуществлять превращения и распознавать вещества.
Оборудование: пробирки, штатив для пробирок, спиртовка, спички, держатель
Химические реактивы: CaCl2, Fe(NO3)3, AgNO3, NaOH, Cu, CuSO4, HCl, H2SO4 конц.
Ход работы:
Задача №1
Дана смесь, состоящая из хлорида кальция и нитрата железа(III). Проделайте опыты, при которых можно определить хлорид-ионы Cl — и ионы Fe 3+ .
Напишите уравнения соответствующих реакций в молекулярном, полном и сокращенном ионном виде.
Для того, чтобы распознать хлорид-ионы Cl —, входящие в смесь, необходимо провести качественную реакцию с ионами – серебра Ag+. Добавим в смесь нитрат серебра, наблюдаем …..
CaCl2 + AgNO3 →
Для того, чтобы распознать ионы - железа Fe3+, необходимо провести качественную реакцию с гидроксид - ионами ОН-. Добавим в смесь гидроксид натрия, наблюдаем…...
Fe(NO3)3 + NaOH →
Задача №2
Осуществите цепочку превращений:
Сu → CuSO4 → Cu(OH)2 → CuCl2
Напишите уравнения соответствующих реакций в молекулярном, полном и сокращенном ионном виде/
1)В пробирку с медными опилками добавим концентрированную серную кислоту и нагреем пробирку, наблюдаем…..
Cu + H2SO4 конц. → (Разобрать реакцию ОВР методом электронного баланса)
2)В пробирку с сульфатом меди добавим гидроксид натрия, наблюдаем……
CuSO4 + NaOH →
3) Для того, чтобы получить хлорид меди, необходимо добавить соляную кислоту. Наблюдаем….
Cu(OH)2 + HCl →
Вывод
Объяснение:
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета
Бронза - это сплав меди с одним или несколькими химическими элементами: оловом, свинцом, цинком, никелем, фосфором, кремнием, марганцем, алюминием, железом. Плотность бронзы 7,5 - 9,3 г/см³, температура плавления 940 - 1093 °C. Используется в качестве материала для деталей машин, арматуры, подвергающихся трению, атмосферному воздействию, а также действию слабых кислот и т. д.
1. Получение этилена из этана. Для этого требуется провести реакцию дегидрирования этана при температуре 300 градусов и катализаторе Cr₂O₃:
ᅠᅠ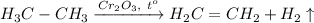
2. Получение 1,2-дибромэтана из этена. Для этого требуется провести реакцию бромирования этилена:
ᅠᅠ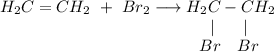
3. Получение этилена из 1,2-дибромэтана. Для этого требуется провести дегалогенирование дигалогеналканов в реакции с цинком при нагревании:
ᅠᅠ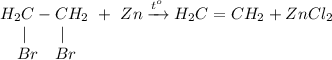
4. Получение этанола из этилена. Для этого требуется провести реакцию гидратации этилена при нагревании и кат. H₃PO₄:
ᅠᅠ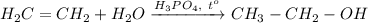
5. Получение этилена из этанола. Для этого требуется провести реакцию внутримолекулярной дегидратации спирта при температуре свыше 140 градусов и при кат. H₂SO₄:
ᅠᅠ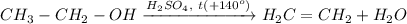
6. Получение этана из этилена. Для этого требуется провести реакцию гидрирования этилена при нагревании и кат. Ni:
ᅠᅠ