1)Составить реакции ионного обмена, уравнять, написать молекулярные, полные и сокращенные ионные уравнения: а) KOH + H2SO4 = сульфат калия и вода
б) Na2CO3 + HNO3 = нитрат натрия + углекислый газ и вода
в) CuCI2 + NaOH = хлорид натрия + гидроксид меди (II)
г) Pb(NO3)2 + Ba(OH)2 = нитрат бария + гидроксид свинца
2) Запишите уравнения диссоциации веществ.
Al(NO3)3; Ba(OH)2; CaCl2; Na3PO4; Ba(OH)2; H2SO4; K2SO4;
3) Подписать у каждого элемента степень окисления, написать полуреакции (схему перехода электронов), указать окислитель и восстановитель и уравнять реакцию:
А) HCIO +Br2 + H2O = HBrO3 + HCI
Б) Zn + CuSO4 = ZnSO4 + Cu
Al + Fe2O3= AI2O3 + Fe
108 г.
Объяснение:
1. Количество моль метана вычисляется по формуле:
n(CH4) =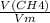 =
= 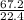 = 3 моль
= 3 моль
V(CH4) дано по условию задачи
Vm - объем молярный, он всегда равен 22.4 л/моль
==============================================
2.
CH4 + 2O2 = CO2 + 2H20
Количество моль метана равно количеству моль воды как коэффицент 1 к 2(по уравнению)
==============================================
3. m(H20) = n(H20) * M(H20) = 6 моль * 18 г/моль = 108 грамм
n(H20) мы вычислили выше
M(H20) можно узнать по периодической таблице. Молярная масса O2 = 16г/моль, а молярная масса H = 1 г/моль. Так как в молекуле воды 2 водорода получается = 16 г/моль + 2 г/моль = 18 г/моль
Для расчетов пользуемся уравнением Аррениуса:
К – константа скорости реакции,
е – основание натурального логарифма,
Т – температура, в К,
R – молярная газовая постоянная 8,31 Дж/моль*К
Еа – энергия активации, Дж/моль,
А – предэкспоненциальный множитель, показывает общее число столкновений.
(A - в процессе решения задачи сократится)
Константа скорости реакции в отсутствии катализатора равна:
Константа скорости реакции в присутствии катализатора равна:
Увеличение скорости реакции определяется из соотношением :
Логарифмируем выражение и получаем:
Вот так задача..
Объяснение: