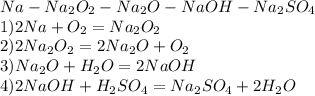1)опредилите массу осадка,образовавшегося в результате окисления 0,2 моль уксусного альдегида избытком аммиачного раствора оксида серебра. 2)вычислить массу и количество вещества оксида кальция,полученного при разложении 100грамм карбоната кальция,содержащего 2% примеси. 3)напиши уравнение реакции с которых можно осуществить следующие превращения: na⇒na₂o₂⇒na₂o⇒naoh⇒na₂so₄
1. Задачу смотри по ссылке(сколько можно ее
2.
98 г х моль
100 г 1 моль
1. Т.к. на чистый карбонат в образце приходится 98%,то определим его чистую массу:
100 г образца - это 100%, а
х г карбоната в нем - 98%, откуда х=98*100/100=98 г
2. Подставив эту массу в уравнение реакции,получим количество вещества оксида:
при разложении 100 г карбоната образуется 1 моль оксида, а
при --//--//-- 98 г___________________х моль, откуда х=98*1/100=0,98 моль
3. Умножив это количества вещества на молярную массу оксида кальция,получим массу его:
m(CaO)=v*M=0,98*56=54,88 г
3.