1,а) соотнесите по классификации основания а) KOH. LiOH .NaOHB) AI (OH)3 Zn(OH)2 CA (OH) 2D) NaOH Mg(OH)2 LiOH1)щелочи 2) нерастворимые основания B)напишите уравнения реакции выбранных нерастворимых основания с серной кислотой 2, даны химические формулы солей: Ca(OH)Cl. KNO3. NaHSO4. CuSO4. BaCO3LiNO2.
Дано:
mр-ра(HCl) = 500г.
Wр.в(HCl) = 30%
Найти:
V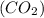 - ?
- ?
1) Рассчитаем массу чистого вещества соляной кислоты: mчист.в-ва(HCl)= mр-ра(HCl) * Wр.в(HCl) / 100%= 500г. * 0,3=150г.;
2) Рассчитаем количество в-ва соляной кислоты, выделевшегося в ходе реакции: n(HCl)= mчист.в-ва(HCl) / M(HCl)= 150г. / 36,5 г/моль= 4,1 моль;
3) Рассчитаем количество в-ва углекислого газа по уравнению реакции: n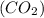 = n(HCl) / 2= 4,1 моль / 2=2,05 моль;
= n(HCl) / 2= 4,1 моль / 2=2,05 моль;
4) Зная кол-во в-ва, можно определить объём углекислого газа: V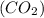 = n
= n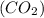 * Vm= 2,05 моль * 22,4 л/моль= 46 л.
* Vm= 2,05 моль * 22,4 л/моль= 46 л.
ответ: V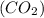 = 46л. Всё!
= 46л. Всё!
-------------------------------------------------------------------------------------------------
Есть вопросы? Задавай Тык
300000 г х л
32 г 22.4 л
1. Определим наличие серы в угле:
m(S)=m(угля)*w(S)=100*0,003=0,3 т или 300 000 г
2. Подставив эту массу в уравнение реакции,получим объем оксида серы(4):
При сжигании 32 г серы образуется 22,4 л оксида, а
при -- // -- 300000 г___________х л, откуда х=300000*22,4/32=210 000 л
3. Так как из полученного объема 99% превращается на оксид серы(6),то выбросы составят 1%,т.е. сотую часть от объема образующегося оксида серы(4):
V(выбросов)=1*210000/100=2100 л или 2,1 м в кубе