A=vRΔT
- кол-во вещества
ΔT - изменение температуры
R=8,3144621 - Универсальная газовая постоянная
m - масс
M - молярная масса
Молярная масса
12+16*2=44
Изменение температуры
Переводим в Кельвины
T2=108 °C=273+108=381 К
T1=20 °C=273+20=293 К
ΔT=T2-T1=381-293=88 К
Дж
A=vRΔT
ΔT - изменение температуры
R=8,3144621 - Универсальная газовая постоянная
m - масс
M - молярная масса
Молярная масса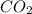
12+16*2=44
Изменение температуры
Переводим в Кельвины
T2=108 °C=273+108=381 К
T1=20 °C=273+20=293 К
ΔT=T2-T1=381-293=88 К